幹/祖細胞池、血管系統以及混合型成骨共同驅動鹿茸骨質每日釐米級生長
iMeta主頁:http://www.imeta.science
研究論文
● 原文: iMeta (IF 33.2,中科院雙一區Top)
● 英文題目: A vaststem-progenitor cell pool, richly vascular system and hybrid ossification drive the daily centimeter-scale elongation of bony antlers
● 中文題目: 幹/祖細胞池、血管系統以及混合型成骨共同驅動鹿茸骨質每日釐米級生長
● 原文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/imt2.70097
● DOI: https://doi.org/10.1002/imt2.70097
● 2025年 12月8日,長春科技學院李春義,巴恆星,中國農業科學院特產研究所王大濤和華大基因劉傳宇、顧穎等在iMeta在線發表了題為“A vaststem-progenitor cell pool, richly vascular system and hybrid ossification drive the daily centimeter-scale elongation of bony antlers”的論文。
● 本研究利用單核 RNA 測序、染色質可及性分析和空間轉錄組學系統解析了鹿茸快速生長的細胞圖譜,為再生性骨修復提供了新的思路。
● 第一作者:巴恆星、何世典、孫海汐、王昕、張航
● 通訊作者:李春義、王大濤、劉傳宇、顧穎、巴恆星
● 合作作者:鄧秋婷、袁月、劉暢、汪珍、李吉萍、謝留威、唐玉嬌、王積梅、馬超、李楠、胡鵬飛、郭倩倩、張國坤、Dawn Elizabeth Coates
● 主要單位:長春科技學院、中國農業科學院特產研究所、華大生命科學研究院
亮 點
● 構建鹿茸生長中心高分辨率多組學圖譜:整合 snRNA-seq、snATAC-seq 與空間轉錄組學,精準解析生長中心的組織結構與細胞構成;
● 揭示幹/祖細胞的快速增殖與低腫瘤化特徵:生長中心的幹/祖細胞展現高度活躍的增殖程序,同時具備獨特的低腫瘤潛能轉錄特徵,闡釋了快速增長與腫瘤抑制之間的穩態平衡;
● 解析驅動釐米級日生長的血管化軟骨生態位:鹿茸在快速生長過程中構建出強烈血管生成的血管化軟骨生態位,有效支撐其極端代謝需求;
● 提出軟骨內成骨與直接轉分化並存的混合成骨模式:鹿茸採用軟骨內成骨與肥大軟骨細胞向成骨細胞直接轉分化並行的混合成骨策略,其中 PHEX⁺細胞可能作為關鍵中間態,為快速成骨提供獨特機制。
摘 要
骨生長與再生仍然是主要的臨牀挑戰。鹿茸作為哺乳動物中生長速度最快的骨組織,通過軟骨內成骨方式再生,並能以每天約2 cm的速度延長,遠超人類生長板每年約2 cm的生長速度。在本研究中,我們利用單核 RNA 測序、染色質可及性分析以及空間轉錄組學系統描繪了鹿茸生長中心(AGC)的細胞圖譜。AGC富含大量幹/祖細胞庫,通過旁分泌信號支持的旺盛增殖驅動其快速延長。這些增殖細胞呈現出內在低腫瘤潛能的轉錄特徵,與凋亡調控相關。此外,AGC構建了一個血管化微環境,支持強勁的血管生成,維持加速的軟骨生長,並促進成骨細胞的高效募集。值得注意的是,鹿茸採用了一種混合成骨策略,將經典的軟骨內成骨與肥大軟骨細胞向成骨細胞的直接轉分化相結合,其過程可能經由 PHEX⁺中間狀態實現。總體而言,該研究結果細化了對軟骨內成骨的基本認識,併為再生性骨修復提供了新的啓示。
視頻解讀
Bilibili:https://www.bilibili.com/video/BV1kMmqBbEz9/
Youtube:https://youtu.be/KqYxRooAoFc
中文翻譯、PPT、中/英文視頻解讀等擴展資料下載
請訪問期刊官網:http://www.imeta.science/
全文解讀
引 言
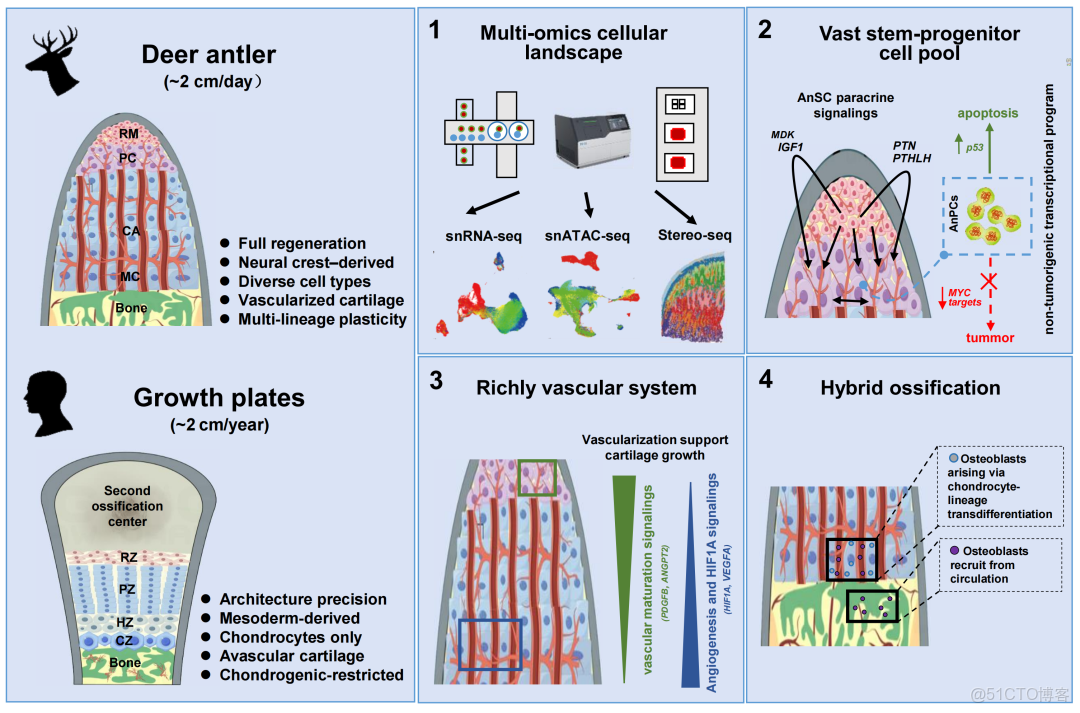
鹿茸每日可延長約2cm,比人體生長板每年約2cm的延伸速度快三百餘倍,代表着哺乳動物中最快的骨再生能力。如此迅速的再生挑戰了經典軟骨內成骨的範式——傳統模式依賴無血管的生長板以及緩慢的軟骨細胞成熟過程。與此相反,鹿茸通過一種血管化的軟骨基質實現再生,持續向鹿角的骨組織轉化。這一過程由鹿茸生長中心(antler growth center, AGC)主導,其為一個高度血管化的生態位,支持快速的軟骨內成骨。來源於顱神經嵴細胞(cranial neural crest cells, CNCCs)的鹿茸間充質幹細胞(AnSCs)是這一機制的核心,但其分化細胞如何實現快速且有序的延長仍不清楚。理解這一獨特體系可為探索一種替代性的骨骼生長方式提供機制啓示,並可能為促進成骨與組織再生、同時降低致癌風險的策略開發提供指導。
在本研究中,我們利用整合單細胞多組學的方法(包括snRNA-seq,snATAC-seq和Stereo-seq),識別出支撐鹿茸驚人延長能力的三項關鍵創新:大規模的、腫瘤風險極低的祖細胞增殖、滿足高代謝需求的血管化軟骨、以及混合型成骨模式。這些創新共同構建了一種“連續流式”的生長模式,使鹿茸能夠維持日均釐米級的骨組織延長。
結果和討論
AGC的多組學細胞圖譜
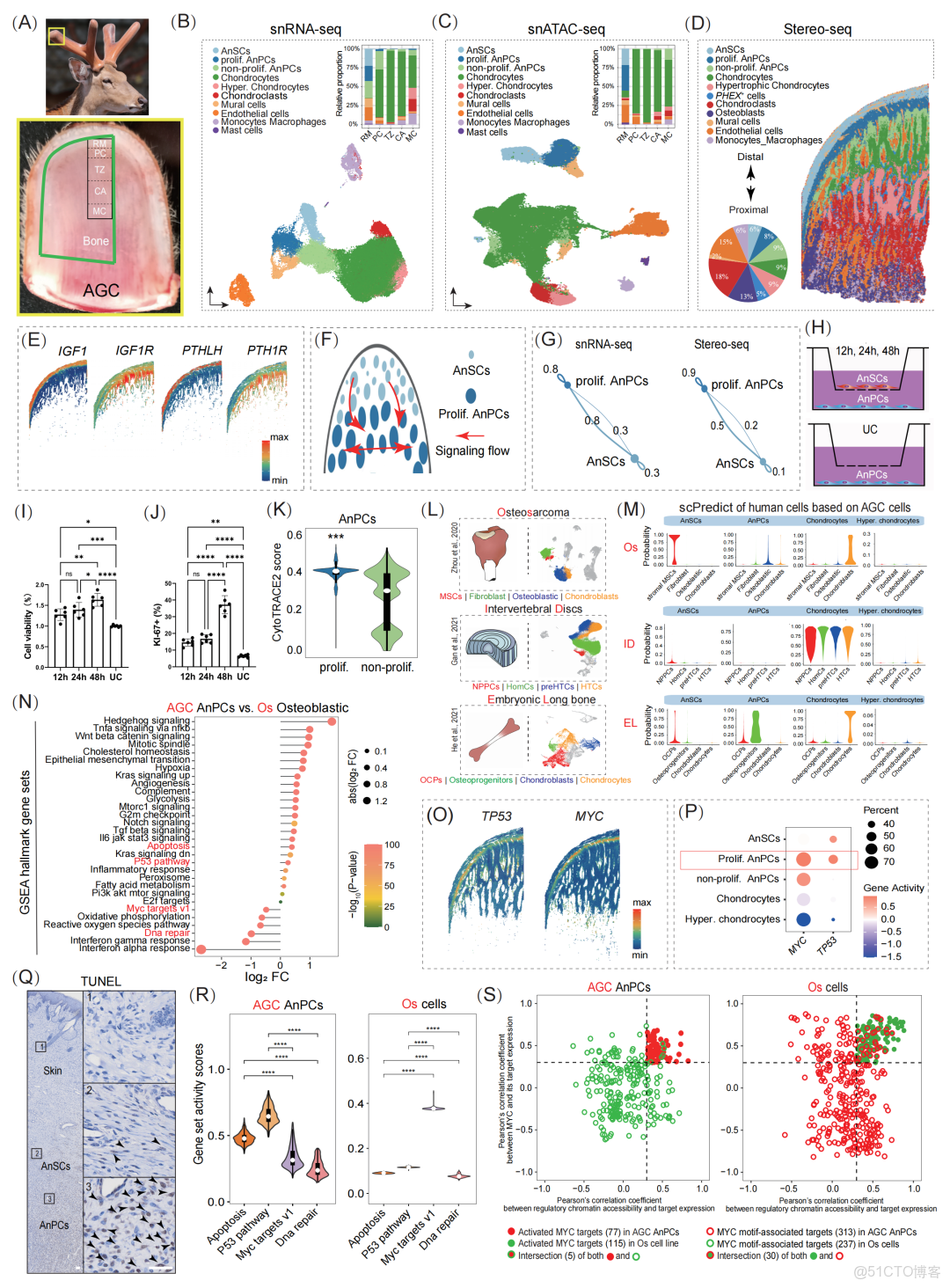
我們採集了AGC內五個解剖學定義的層次:儲備間充質(RM)、前軟骨區(PC)、過渡區(TZ)、軟骨區(CA)與礦化軟骨區(MC)(圖1A),構建了一個空間解析的鹿茸延長框架。snRNA-seq測序獲得了53,949個高質量細胞核(圖S1A-D),並基於經典標記基因鑑定了10種細胞類型(圖1B),包括NT5E+TWIST2+SFRP2+RXFP2+的AnSCs,含有MKI67+增殖亞羣的TNC+TNN+AnPCs,COL2A1+軟骨細胞、COL10A1+肥大軟骨細胞、ACP5+成骨破壞細胞、ACTA2+管腔周細胞(mural cells)、PECAM1+CDH5+內皮細胞、CSF1R+單核/巨噬細胞以及TPSB2+肥大細胞(圖S2A-C)。其中,增殖型AnPCs佔比顯著,強調了其在快速生長中的作用。細胞類型特異性差異表達基因進一步支持這些註釋(圖S2D)。對bulk RNA-seq數據的去卷積分析顯示了高度一致的細胞組成(圖S2E)。
snATAC-seq(57,722個細胞)產生一致的相同的十個細胞類型(圖1C、S3-S4)。跨組學整合分析表明高度一致性:細胞類型匹配率達87.6%,組織層級匹配率達98.9%,且轉錄組與染色質可及性之間的相關性極高(Pearsnotallow=0.89–0.99,圖S4D-E)。
Stereo-seq(57,311個細胞)解析出11種細胞類型(圖1D,S5-S6),除肥大細胞因丰度極低未被捕獲外,其餘皆被識別。空間映射揭示了從遠端AnSCs→AnPCs→軟骨細胞→肥大軟骨細胞→PHEX+細胞的明確分化層級。PHEX編碼一種對磷代謝和礦化至關重要的金屬蛋白酶。PHEX+細胞(約5%)位於肥大軟骨細胞周圍,可能代表一種終末軟骨狀態,對礦物沉積作出貢獻。成骨細胞(約13%)主要位於MC層下方的成骨區域,與快速骨形成的特點相一致。
圖 1. AGC 多組學細胞圖譜及 AnSC 促進 AnPC 增殖揭示與骨肉瘤截然不同的轉錄程序
(A) 顯示 AGC 的解剖位置以及 snRNA-seq、snATAC-seq 和 Stereo-seq 的取樣部位。AGC 自遠端至近端可區分為五個組織學層:貯備間充質層(RM)、軟骨前體層(PC)、過渡區(TZ)、軟骨層(CA)和礦化軟骨層(MC)。(B) snRNA-seq 的 UMAP 圖展示了十種不同細胞類型,柱狀圖顯示它們在五個組織層中的相對比例。(C) snATAC-seq 的 UMAP 圖顯示一致的細胞類型,柱狀圖顯示其在五個組織層中的相對比例。(D) Stereo-seq 的空間圖揭示了 11 種細胞類型的空間分佈。餅圖顯示各細胞類型所佔比例。(E) IGF1 及其受體 IGF1R、PTHLH 及其受體 PTH1R 在 AnSCs 和 AnPCs 中的空間表達模式。(F) 基於 CellChat 推斷的 AnSCs 與增殖性 AnPCs 之間,以及增殖性 AnPCs 之間的細胞通訊示意圖。(G) 基於 snRNA-seq(左)還是 Stereo-seq(右),AnSCs → 增殖性 AnPCs 的信號強度均高於反向。(H) AnSC–AnPC 共培養實驗示意圖。UC:未處理對照。(I) 不同時間點(12、24、48 h)AnPC 的細胞活性(n = 6),呈時間依賴性上升。(J) 不同時間點(12、24、48 h)AnPC 的增殖能力(n = 6),呈時間依賴性上升。顯著性比較採用單因素方差分析及 Tukey 事後檢驗。****p < 0.0001,**p < 0.01,*p < 0.05。誤差線:標準差(SD)。(K) 增殖性與非增殖性 AnPC 的 CytoTRACE2 小提琴圖。兩者之間採用 Wilcoxon 秩和檢驗:***p < 0.001。(L) 分析組織示意:骨肉瘤(Os)、椎間盤(ID)和胚胎長骨(EL),並展示其 UMAP 中的軟骨/骨相關細胞類型。(M) 小提琴圖顯示基於 scPred,以 AnSC 來源細胞為參考,對 Os、ID 和 EL 中軟骨/骨相關細胞類型的預測概率。(N) 棒棒糖圖顯示 AGC 中 AnPC 與 Os 成骨細胞之間 GSEA hallmark 基因集中 AUCell 活性的顯著差異。顯著性採用 Kruskal–Wallis 檢驗及 Dunn 事後檢驗。(O) TP53 和 MYC 在 AGC 的空間表達,主要在 AnPCs 中表達。(P) snATAC-seq 顯示 TP53 和 MYC 基因座的染色質可及性,以 AnPCs 為主。(Q) 鹿茸皮膚與 RM 層(AnSCs 和 AnPCs)的 TUNEL 染色。黑色箭頭標示 TUNEL 陽性細胞。皮膚沒有凋亡細胞,而 AnPCs 中大量存在。比例尺:50 μm。(R) snATAC-seq 顯示 AGC AnPC 與 Os 細胞(Pontius et al., 2023)的關鍵 hallmark 基因集活性差異。Kruskal–Wallis + Dunn 檢驗,****p < 0.0001。(S) 散點圖顯示 MYC 表達與靶基因表達的 Pearson 相關係數,以及調控染色質可及性與靶基因表達的相關性。僅有 5 個 Os 中活化的 MYC 靶基因在 AnPCs 中被激活,而 AnPCs 中 30 個活化靶基因在 Os 中也處於活化狀態。
AnSC信號驅動AnPC增殖,AnPC可能具有多譜系潛能
AnPCs包含一個遠端增殖亞羣,支持鹿茸組織的快速附加式擴增。IGF1(已知可在體外促進AnSCs增殖)在AnSCs中表達,而其受體IGF1R在增殖型和非增殖型AnPCs中均富集(圖1E)。PTHLH及其受體PTH1R在AnSCs和非增殖型AnPCs中高表達,與其延緩分化的作用相符。這些模式提示AnSCs通過旁分泌信號維持AnPC增殖並防止其過早分化(圖1F)。基於snRNA-seq與Stereo-seq的細胞通訊分析顯示,相比AnPCs,AnSCs向增殖型AnPCs傳遞更強的信號(圖1G, S7A-B),進一步支持了其維繫祖細胞庫的關鍵作用。體外共培養實驗(圖1H)也證實,AnSC分泌因子可增強AnPC的活力(圖1I)和增殖(圖1J),強調了AnSC信號在鹿茸快速生長中的核心地位。增殖型AnPCs受TWIST2、MEOX2、EGR2、PRRX2、ZNF37A等關鍵轉錄因子的調控(圖S7C-E)。富集分析顯示這些細胞具有較高的細胞可塑性和多譜系分化潛能(圖1K,S7F-G)。綜上,一個豐沛的幹-祖細胞庫構成了鹿茸釐米級日增長的基礎。與體生長板不同,AGC以一種為最大化延長而優化的連續運行體系運作。這一“連續流式”結構由系統性內分泌信號和局部自/旁分泌生長因子信號共同調控。
AnPCs與骨肉瘤細胞轉錄組特徵差異明顯
將AGC細胞與骨肉瘤(Os)、正常椎間盤(ID)和胚胎長骨(EL)比較發現,AnSCs在轉錄上類似Os中的基質間充質幹細胞,但屬於正常、非惡性羣體。儘管高度增殖,AnPCs與Os中代表惡性細胞的成骨細胞相似性極低(圖1L-M, S8A-E)。GSEA hallmark分析進一步區分了二者:AnPCs富集了凋亡與p53相關通路,而Os成骨細胞則富集DNA修復和MYC靶基因集合(圖1N)。凋亡相關基因(TP53、CASP3、ANXA5、ANXA6、BAK1、BID)在AnPCs中高表達(圖1O, S9A-B),TP53的染色質可及性也在AnPCs中升高(圖1P),與增殖區顯著的TUNEL陽性信號相一致(圖1Q)。
雖然MYC在AnPCs中表達(圖1O)並具有開放染色質(圖1P),但snATAC-seq顯示其靶基因活性遠低於Os細胞(圖1R)。在Os中被激活的MYC靶基因中,僅有5個在AnPCs中呈現相同模式,而AnPCs則獨立激活了30個MYC靶基因(圖1S)。這些結果表明,鹿茸快速延長並非依賴致癌程序或增強的DNA修復,而是由增殖與凋亡之間的受控平衡維繫。在AnPCs中,MYC觸發了一種非腫瘤性的替代轉錄程序,使其在快速生長的同時避免惡性轉化。
AGC微環境支持血管再生,促進軟骨生長與成骨
為探究AGC微環境如何支持血管發育,我們沿着AnSC分化軌跡分析了血管相關通路的AUCell活性(圖2A,S10)。AGC近端呈現明顯的低氧生態位,HIF1A信號(r=0.84)、細胞缺氧反應(r=0.89)、內皮細胞遷移(r=0.84)和血管生成(r=0.84)高度富集,HIF1A與VEGFA表達顯著升高(圖2B)。相比之下,AGC遠端富集血管分支(r=0.77)和血管成熟(r=0.82)相關通路,並呈現PDGFB與ANGPT1的高表達(圖2B)。免疫熒光染色進一步驗證了這些空間表達模式(圖2C)。
周細胞和內皮細胞主要在RM和PC層高度增殖(圖S11A-B),具有更高比例的活躍細胞(CytoTRACE2 > 0.3,圖2D)。跨組織比較顯示,AGC中活躍的周細胞與內皮細胞比例均高於ID(椎間盤)和Os(骨肉瘤)(圖S11C)。這些活躍細胞呈現促血管生成特徵,上調PTN–SDC1、MDK–SDC1、WNT5A–FZD和VEGFA–KDR,而與血管成熟或鈣化相關的通路(如BMP2/4/6–BMPR1A/BMPR2、VEGFA–FLT1和PDGFA/D–PDGFRB)下調(圖S11D-E)。轉錄因子活性與分化潛能呈正相關(圖2E),提示AGC擁有一個處於再生活躍狀態、偏向血管生成而非終末成熟的血管網絡。
與無血管的體生長板相比,AGC中的血管化軟骨具有三大優勢:(1)為軟骨細胞提供增強的代謝支持,使肥大軟骨細胞得以保持與血管直接接觸,從而避免缺氧誘導的凋亡;(2)具有更高的空間靈活性,可實現快速的附加性軟骨生長;(3)促進高效成骨,因為血管允許成骨細胞迅速抵達礦化前沿。這些結構創新突破了傳統無血管軟骨在肥大擴增方面的代謝限制。
圖 2.AnSC 衍生細胞構建血管化生態位驅動血管發育。PHEX⁺細胞通過 Hedgehog 信號促進軟骨礦化,並可能作為肥大軟骨細胞直接轉分化為成骨細胞的中間狀態
(A) AnSC 衍生細胞沿發育軌跡的血管發育相關生物過程AUCell 得分。下方為細胞在偽時間中的分佈(分箱表示)。細胞類型顏色參考圖 1B。(B) snRNA-seq(左)和 Stereo-seq(右)中代表性標記基因表達動態。(C) AGC 的免疫熒光成像顯示血管發育。僅由內皮細胞構成的血管(黃箭頭)代表血管生成;成熟血管以白箭頭標示。紅色:內皮細胞;綠色:周細胞。(D) 五個組織層中內皮細胞和周細胞的 CytoTRACE2 小提琴圖。激活/靜息狀態以 CytoTRACE2 = 0.3 為閾值。(E) 與激活或靜息狀態相關的轉錄因子散點圖。顯示 TF 表達與 CytoTRACE2 的 Pearson 相關係數,並標註前五位 TF。(F) 軟骨細胞、肥大軟骨細胞和 PHEX⁺細胞的空間分佈。(G) 基於CellChat 推斷這三類細胞之間的 Hedgehog(HH)信號互作環形圖。(H) HH 信號通路代表基因的空間表達模式。(I) MMP9 和 MMP13 的空間表達。(J) RUNX2 的 UMAP 圖(左上)及空間圖(左下)。免疫組化確認 RM(右上)和 MC(右下)層中 RUNX2 蛋白表達。RM 層含大量陽性細胞;MC 中肥大軟骨細胞陽性以黑箭頭標示。比例尺:50 μm。(K) PHEX⁺細胞和成骨細胞的空間定位(重複展示以便理解)。OB-d 和 OB-p 的定義參考圖 2F。(L) PHEX⁺細胞和成骨細胞的空間定位。左上為細胞類型定位,左下為放大區域。右側示意 OB-p(綠色)和 OB-d(紅色)相對於 PHEX⁺細胞的空間位置。(M) Monocle3 推斷的發育軌跡顯示細胞從軟骨細胞、肥大軟骨細胞,經 PHEX⁺細胞向 OB-d 分化。OB-d 為終末聚類。(N) StaVia 推斷的偽時間軌跡顯示相同分化方向,並呈現兩個終點:肥大軟骨細胞和 OB-d(黑箭頭)。(O) snRNA-seq 代表基因沿偽時間的表達動態。顏色對應圖 2M。(P) 異源移植鹿茸模型示意:無血管軟骨(AC-antler)。在第 30 天 H&E 和 Alcian blue 可見無血管軟骨結節及早期成骨(黑框),第 60 天明顯擴大。(Q) 採用表達RFP 的裸鼠進行的異源血管化軟骨模型(VC-antler,60 天)免疫熒光顯示。BGLAP(胞漿)和 SP7(細胞核)表達可見。RFP⁺ 宿主細胞主要參與血管形成。由血管周圍的成骨細胞以黃箭頭(OB-p)標示;由肥大軟骨細胞/PHEX⁺細胞轉分化的成骨細胞以白箭頭(OB-d)標示。未對所有陽性細胞進行標註。比例尺:200 μm。
PHEX⁺細胞通過Hedgehog信號參與鹿茸軟骨礦化
PHEX⁺細胞約佔全部細胞的~5%。空間定位顯示其主要分佈於肥大軟骨細胞周圍(圖2F)。snRNA-seq(圖S12A-C)與snATAC-seq(圖S12D-F)均表明PHEX⁺細胞屬於軟骨細胞亞羣。其高表達基因顯著富集於骨礦化過程(p=8.16×10-⁷),包括LGR4、FITM5、ASPN、IBSP、LOX和BGLAP(圖S12G-H)。CellChat分析顯示軟骨細胞與肥大軟骨細胞向PHEX⁺細胞存在強的信號輸入,其中Hedgehog(HH)信號是關鍵軸(圖2G,S12I)。軟骨細胞表達IHH,而受體PTCH1和SMO在PHEX⁺細胞中高度富集(圖2H),表明存在配體–受體互作。PHEX⁺細胞中HH抑制因子HHIP也顯著上調,提示對HH信號的精細調控。此外,PHEX⁺細胞表達的MMP9和MMP13(圖2I)可能促進血管侵入及成骨細胞募集,有利於骨基質沉積。
肥大軟骨細胞通過PHEX⁺細胞向成骨細胞轉分化
基因富集分析顯示,PHEX⁺細胞高表達的基因(如IBSP、BGLAP、SPP1、SP7、LOX和COL1A1;圖S12G-H、S12J)與成骨細胞分化密切相關(p=6.83×10-¹³),提示其具有成骨樣轉錄特徵。哺乳動物胚胎和早期後生的內軟骨成骨過程中,已有研究報道部分肥大軟骨細胞可逃避凋亡,並在RUNX2作用下轉分化為成骨細胞。在AGC中,RUNX2在AnPC和肥大軟骨細胞中均高表達(圖2J),提示肥大軟骨細胞可能通過PHEX⁺中間態轉分化為成骨細胞。然而,由於鹿科動物缺乏可行的譜系示蹤工具,我們無法直接驗證。
為突破這一限制,我們利用AGC的空間結構識別了兩類成骨細胞:OB-d,僅位於PHEX⁺細胞鄰近區域;以及OB-p,分佈於與PHEX⁺無直接接觸的區域(圖2K)。降維分析證實OB-d與OB-p為不同的成骨亞羣(圖2L,S12K)。偽時間軌跡顯示,從軟骨細胞和肥大軟骨細胞,經PHEX⁺中間態,逐漸分化為OB-d(圖2M)。軌跡呈現兩個端點:一個為肥大軟骨細胞,另一個為OB-d(圖2N)。沿着這一軌跡,成骨相關基因(如IBSP、SPP1、BGLAP、SP7)逐級上調,而肥大軟骨標誌COL10A1下調(圖2O),提示轉分化過程。
為進一步驗證體內轉分化,我們採用裸鼠異種移植模型。在移植的鹿茸幹細胞組織(AP)中誘導形成無血管軟骨結節。移植30天后,無血管軟骨結節中央出現成骨細胞,未見軟骨破裂跡象;60天后,成骨細胞廣泛分佈於骨小梁和編織骨中(圖2P)。
在另一模型中,我們在表達RFP的裸鼠中誘導生成血管化軟骨。先前研究表明這類異種鹿茸中的血管內皮細胞主要來自宿主。對成骨標誌物(BGLAP和SP7)的免疫熒光顯示:紅色血管周圍存在OB-p,而無血管軟骨/骨結節內部存在OB-d(圖2Q)。儘管無法進行直接譜系示蹤,但該模型提供了最有力的體內證據。其結論與哺乳動物胚胎和早期後生內軟骨成骨中“終末肥大軟骨細胞可轉分化為成骨細胞”的經典原理一致。但由骨髓來源的OB-p是AGC快速成骨的主要驅動者。綜上,這些結果表明,AGC中一小部分成骨細胞由軟骨譜系直接轉分化而來,可能通過PHEX⁺中間態。
結 論
鹿茸通過在空間與時間上擴展增殖區,同時在尖端承擔極低機械負荷,從而實現極端快速的每日增長。相比之下,體生長板則必須維持高度結構精確性與機械強度,以支撐體重和運動。因此,鹿茸在發育早期即血管化以滿足巨大的代謝需求,而體生長板仍保持無血管,以維持區域化結構。在成骨階段,鹿茸將凋亡信號轉化為軟骨細胞轉分化的觸發因素,而體生長板則推動其進入終末分化。體生長板更像“分區流水線”,而鹿茸則運行一個“連續流動系統”,最大程度減少過渡時間,從而實現卓越的生長速度。這些適應性改變很可能是在強烈的季節性快速再生選擇壓力下形成的,使馬鹿等大型物種能夠在約90天內生長長達~1.5m、重約~30kg的鹿茸。未來研究應探索這些機制是否可用於促進人體骨組織在臨牀環境中的快速再生與修復。
方 法
詳細的實驗材料與方法均列於補充材料中,包括樣本採集,單細胞多組學分析,實驗驗證及統計方法等。
代碼和數據可用性:
本研究的所有支撐數據均包含在正文和補充材料中。原始測序數據可通過中國國家基因庫數據庫(CNGBdb)公開獲取,登錄號為CNP0003724。用於主要圖件的處理後數據以及所有分析腳本可在GitHub獲取:https://github.com/heshidian/DeerAntlersSingleCell。更詳細的數據信息可聯繫通訊作者獲取。補充材料(文本、圖、表、中文翻譯版本或視頻)也可從線上(http://www.imeta.science/)獲取。
引文格式:
Hengxing Ba, Shidian He, Haixi Sun, Xin Wang, Hang Zhang, Qiuting Deng, Yue Yuan, et al. 2025. “A vaststem-progenitor cell pool, richly vascular system and hybrid ossification drive the daily centimeter-scale elongation of bony antlers.”iMeta 4: e70097. https://doi.org/10.1002/imt2.70097.
作者簡介
巴恆星(第一作者)
● 長春科技學院鹿茸科學與產品技術研究所 研究員。
● 研究方向為鹿及鹿茸生物學,吉林省高層次人才,吉林省梅花鹿全產業鏈精準檢測創新中心主任,中國鹿業協會理事等。從事鹿及鹿茸生物學研究20餘年,以第一作者(含共同)在iMeta、PNAS等期刊發表鹿及鹿茸相關研究論文39篇。授權發明專利5項。獲吉林省科技進步獎項一等、二等共6項。
何世典(第一作者)
● 中國科學院大學生命科學學院(華大專項) 在讀博士研究生。
● 研究方向為單細胞多組學,以第一作者(含共同)在iMeta、Cell Reports、Medicine期刊發表論文3篇。
孫海汐(第一作者)
● 2013年博士畢業於中國科學院遺傳與發育生物學研究所, 華大生命科學研究院主任科學家,研究員。
● 主要研究方向為生物信息學,開發了多個多組學、單細胞與空間轉錄組測序相關的生物信息學分析技術,構建了多套人和動植物生理、病理過程的多組學圖譜。基礎研究和企業研發經歷豐富,在Cell、iMeta、Cell Stem Cell等期刊上發表論文50餘篇,發表生物信息方法學著作2章,申請專利7項、獲批軟著9項。
王昕(第一作者)
● 武漢大學生命科學學院博士,,美國貝勒醫學院博士後。
● 研究方向為單細胞多組學與時空組學,以第一作者(含共同)在iMeta、Science Advances、Hepatology等期刊發表SCI論文6篇。
張航(第一作者)
● 中國農業科學院特產研究所,在讀碩士研究生。
● 研究方向鹿茸生物學,在iMeta期刊上發表論文1篇。
李春義(通訊作者)
● 長春科技學院鹿茸科學學與產品技術所所長,教授,吉林省鹿茸生物學重點實驗室主任,吉林省幹細胞學會副理事長,兼任吉林農大和吉林大學博導。
● 從事幹細胞與鹿茸生物學研究40餘年。1997年新西蘭Otago大學醫學院獲得博士學位。現任Cell Death and Disease 執行主編。主持中科院A類先導專項、國自然重點項目2項、面上項目4項、國家863、973子課題各1項。以通訊作者在Science、iMeta、PNAS、Cell Death and Differentiation等雜誌上發表論文160餘篇;撰寫著作4部,授權發明專利14項。1990年獲中國科協頒發的“中國青年科技獎”;2003年獲International Research Promotion Council 頒發的“Eminent Scientist”傑出科學家獎;3項吉林省“科學技術進步二等獎”(均第一);1項“國家科技進步二等獎”(第三名);1項吉林省自然科學一等獎(第一名);1項吉林省自然科學二等獎(第一名);鹿茸再生研究入選2023年度“中國農業科學十大進展”。20餘次在國際大會、分會做主旨演講。已指導博士生16人,碩士生60餘人。
王大濤(通訊作者)
● 中國農業科學院特產研究所,研究員,特種動植物生物技術團隊首席科學家。
● 吉林省高層次人才。研究方向鹿茸生物學,以第一作者/通訊作者(含並列)在Science、iMeta、PNAS等期刊發表鹿茸相關研究論文22篇。獲得吉林省自然科學獎一等獎1項。授權發明專利6項。
劉傳宇(通訊作者)
● 華大研究院 基因組多維解析技術全國重點實驗室研究員,深圳市數字化細胞病理概念驗證中心主任。
● 獲得中國博士後科學基金特別資助(一等資助),國家重點研發計劃課題負責人。深圳市高層次人才,鹽田區梧桐人才。代表性工作有單細胞多維組學技術 scCAT-seq(Nat. Commun.,2019)、HT-scCAT-seq(Genome Biology,2025)、基於DNA納米球的細胞組學技術Stereo-cell(Science,2025);人類全能幹細胞8CLC誘導(Nature,2022a)、獼猴單細胞轉錄組圖譜(Nature,2022b)、中國人羣免疫多組學圖譜CIMA(Science接收,2026)。近5年以第一或通訊作者在Science, Nature, Nat. Commun., Genome Biology等雜誌發表論文32篇。申請國際發明專利22項(授權4項),中國發明專利18項(授權5項),軟著6項。
顧穎(通訊作者)
● 華大集團技術副總裁,華大細胞 CEO,華大研究院資深副院長,基因組多維解析技術全國重點實驗室副主任,研究員。
● “十四五”國家重點研發計劃項目首席科學家。長期深耕細胞生物學領域,成果豐碩。在再生衰老機制研究中,構建全球首份多器官衰老時空圖譜,發現新型衰老預警生物學標誌物;解析蠑螈斷肢及腦再生機理,揭示物種嵌合競爭機制,為抗衰老和再生醫學提供理論基礎。近5年發表第一或通訊作者文章18 篇,獲授權發明專利20件。其中,多器官衰老時空圖譜、蠑螈腦時空圖譜研究分別發表於 Cell 和 Science,併入選 2024、2022年度“中國生命科學十大進展”。